酸堿溶液混合後溶液酸堿性的判斷是一個高中化學的常考點,而常溫下pH=2的強酸與pH=12的弱堿等體積混合後,溶液最終會呈堿性,這是高中生在化學學習中往往搞不清的難點,易于鹽類的水解相混淆。究其根本,往往是因為他們沒有清晰的理解一定pH的弱堿。
我們以問題中pH=12的弱堿為例,可以看成是弱堿氨水,少部分電離,
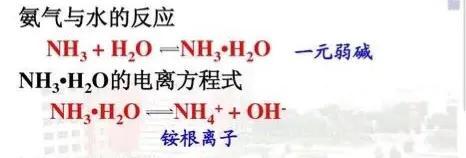
由于電離程度較小,所以在pH=12的氨水中還存在着大量未電離的NH3分子,與pH=2的強酸中和,注意這時與酸中和的可以認為是已電離出的OH-,若強酸為鹽酸,那麼最終剩下的溶質就應該是少量NH4Cl與大量NH3分子(這個判斷均可來自于NH3.H2O電離程度較小)。
所以最終的酸堿性是由大量剩餘NH3.H2O電離所決定的,而不是少量NH4Cl的水解所引起的。
,