來源:【中國科學院】
α-突觸核蛋白(α-syn)作為帕金森病(PD)、路易體癡呆(DLB)、多系統萎縮(MSA)等神經退行性疾病的關鍵緻病蛋白,具有在不同條件下形成不同結構和病理毒性的澱粉樣纖維聚集的能力。近期研究發現,來自MSA,PD及DLB患者腦中的α-syn病理纖維結構均含有不同的化學配體通過與附近氨基酸殘基的非共價作用參與特定α-syn聚集纖維構象的形成。盡管這些化學配體尚未獲得鑒定,但顯然與α-syn纖維的構象選擇以及病理毒性高度相關。因此,不同的化學配體如何影響α-syn病理聚集并決定纖維結構是本領域的重要的前沿科學問題。
中國科學院上海有機化學研究所生物與化學交叉研究中心劉聰課題組與上海交通大學Bio-X研究院李丹課題組合作,在《自然-通訊》(Nature Communications)上,發表了題為Heparin induces α-synuclein to form new fibril polymorphs with attenuated neuropathology的研究成果,報道了富含負電的糖胺聚糖——肝素(heparin)能夠高效的誘導α-syn形成全新構象的聚集纖維複合物(hep-α-syn)。hep-α-syn纖維複合物通過削弱α-syn纖維被細胞攝取的效率以及播種能力,減弱其在神經元上的病理毒性。進一步的機制研究發現,heparin作為長鍊生物多聚物能夠通過在分子内和原纖維間水平上重排α-syn的電荷互作模式來調控α-syn纖維的折疊和組裝,從而誘導産生具有全新結構的α-syn纖維構象。該研究揭示了化學配體在調控病理澱粉樣纖維的構象選擇和病理毒性中的重要作用。
研究發現,相比于apo-α-syn對照組,糖胺聚糖heparin顯著加速α-syn單體的聚集纖維化速率并誘導其形成具有不同形态的hep-α-syn纖維(圖1)。更為重要的是,具有新穎形态的hep-α-syn纖維與apo-α-syn纖維對比,在神經元水平呈現出顯著降低的病理毒性(圖1)。研究通過更細緻的表征hep-α-syn纖維複合物的“病理功能畫像”(pathological profile)發現,heparin誘導産生纖維神經病理毒性的降低是通過三方面來實現,即削弱纖維與神經元細胞表面結合、降低纖維被神經元細胞攝取的效率、抑制纖維在神經元中播種和誘導内源α-syn聚集的能力。
進一步,研究運用冷凍電鏡(cryo-EM)三維螺旋重構技術,解析了hep-α-syn纖維的高分辨率電鏡結構,發現了其由4種不同的纖維構象(polymorphs)構成(分别命名為Hep-P1、Hep-P2、Hep-P3、Hep-P4)。在hep-α-syn的polymorphs結構中可以明确觀察到存在于α-syn纖維周圍或原纖維界面的額外密度,這些密度靠近α-syn表面的賴氨酸(Lys)殘基(圖2)。研究通過分子對接搭建heparin和α-syn纖維相互作用的原子模型,發現作為富含負電的生物聚合物,heparin能夠通過其磺酸基團沿纖維軸結合在由Lys形成的正電表面上(圖2)。
進一步分析發現,Hep-P1、Hep-P2及Hep-P3的原纖維核心結構與體外重構的α-syn polymorph 2相似,而heparin與Lys的電荷相互作用穩定了這些polymorphs的原纖維組裝界面,從而介導新的polymorphs形成。在Hep-P1中,heparin穩定了α-syn的單股原纖維表面;而在Hep-P3中,heparin介導兩股原纖維形成新的組裝界面(圖3)。此外,heparin通過誘導分子内的結構重排,使Hep-P4折疊成全新的“Z”形構象。Heparin與Lys80的靜電相互作用使其暴露于溶劑中,并阻止了N端的包裹。Hep-P4纖維核心的N端具有與α-syn Polymorph 2相似的拓撲結構,其C端具有與α-syn Polymorph 1相似的拓撲結構,使其表現為α-syn纖維結構中兩種常見“構象原型”(prototype)的混合體纖維構象。
該研究通過對hep-α-syn纖維複合物的動态組裝機制、細胞毒性以及纖維原子結構的系統研究,闡釋了糖胺聚糖作為一種特定形式的化學配體是如何通過複雜的非共價相互作用調控病理澱粉樣纖維的折疊和組裝并影響其病理毒性。該工作為剖析其他生物大分子誘導病理澱粉樣纖維聚集體在神經退行性疾病中的演化和病理作用奠定了基礎,并為設計與發展化學配體抑制神經退行性疾病關鍵蛋白聚集體的病理毒性提供了新思路。
浙江大學生命科學學院、四川省人民醫院神經病學研究所的科研人員參與研究。
論文鍊接
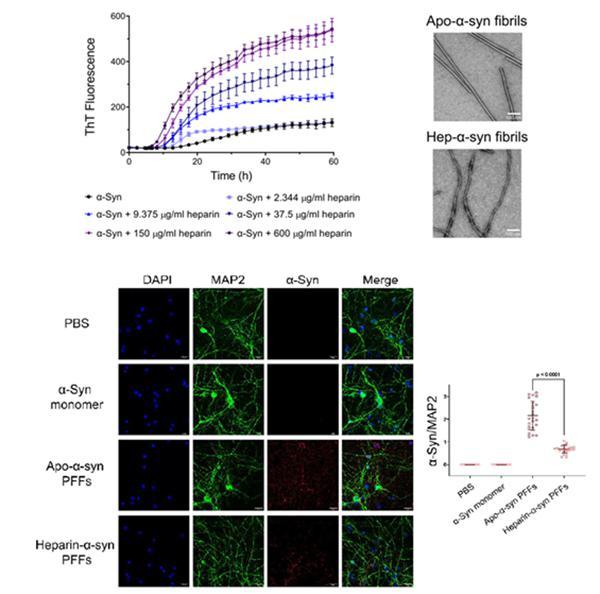
圖1.Heparin誘導促進α-syn形成全新纖維構象,并呈現顯著降低的神經元毒性
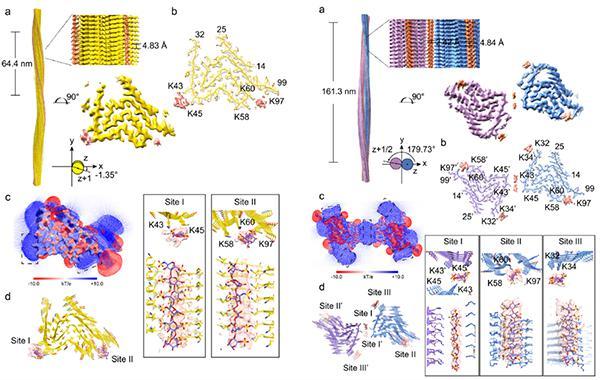
圖2.Heparin誘導α-syn形成具有構象多态性的纖維原子結構分析
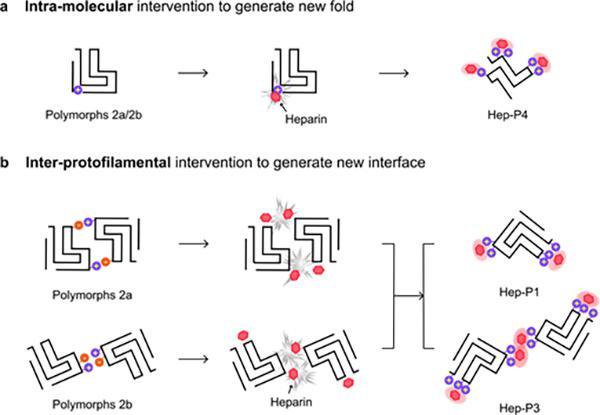
圖3.Heparin誘導α-syn形成不同polymorphs的機制示意圖
本文來自【中國科學院】,僅代表作者觀點。全國黨媒信息公共平台提供信息發布傳播服務。
ID:jrtt
,